侧向免疫层析测定的开发可以分为两个重要的部分:膜特性的标准化和分析物-检测抗体之间分子水平免疫检测反应的优化。在开始的阶段,我们必须用其他技术,如ELISA,检查捕获抗体和检测抗体与分析物的反应特异性。结合缓冲液的摩尔浓度和pH值对分析物和抗体之间的免疫反应具有重要意义。同时,我们也检验讲捕获抗体和检测抗体的表位图用来确认检测的特异性。
膜特性的标准化则通过其孔隙度、疏水性、蛋白质容纳/释放能力和吸水率直接关系到检测的灵敏度。在优化好的条件下,一个完美的侧向免疫层析测定应该具有高通量(目标结合效率)、低通量(目标释放效率)和低交叉反应性。
在这篇文章中,我们将分享我们的经验,特别是在开发策略和故障排除方面的经验,这些经验是我们在开发侧向免疫层析测定试剂盒时逐步积累的。
简介
基于免疫层析原理的侧向层析测定早作为诊断和预后工具中表现出广泛的应用。侧向层析测定的目标分析物包括传染病制剂、滥用药物、激素、癌症标志物、食品污染物和农业污染物[1, 2]。硝化纤维膜的测试线和质控线中的抗原和抗体反应导致的颜色形成提供了分析物的定性检测。定性检测可以通过定制设备转化为定量检测,这些设备可以将颜色强度或荧光量化。侧向免疫层析测定(LFIA)是一种经济实惠的技术,旨在于5-30分钟的短时间内快速检测分析物[3, 4]。
免疫测定(夹心法)是用于检测蛋白质/肽类抗原的原理,而免疫测定(竞争法)则用于基于类固醇的小尺寸抗原和滥用药物的检测[5, 6]。如今,多重测定被广泛使用,它可以在一次检测中同时检测多种分析物。根据分析物的性质,LFIA可以被分为检测抗体的快速检测和检测抗原的快速检测。怀孕(HCG)、疟疾P.f/Pan、疟疾P.f/P.v、登革热NS1的快速检测是抗原检测快速诊断试验(RDTs)的例子,而登革热IgG/IgM、苍白球菌抗体的快速检测则属于抗体检测RDTs。在抗原检测试验中,必须选择具有不同表位的两种不同的单克隆抗体,并进行免疫测定(夹心法)以获得颜色。
一级抗体或捕获抗体被涂在硝化纤维素膜上,二级抗体或检测抗体与金纳米粒子或乳胶纳米粒子结合,后者将被涂在结合垫上。对于抗体检测试验,分析物的抗抗体被认为是捕获抗体,涂有纳米颗粒的抗原将被用作检测分子。在竞争性检测抗原的情况下,只有一个单克隆抗体可以使用,并被认为是捕获抗体。标准抗原将与纳米粒子结合,然后让它与样品中的抗原竞争。对于抗体检测的竞争性试验,结合的标准抗体和血液中的抗体之间会发生竞争,以与涂在硝化纤维素膜上的抗原结合。由于结合的和未结合的分析物之间的竞争,测试线中没有颜色将是阳性测试,形成颜色则是阴性结果。在所有情况下,质控线由山羊抗小鼠抗体作为捕获抗体,相应的小鼠抗体与纳米颗粒结合后将被涂抹在结合垫上。如果质控线不显示颜色,则试验将被认为是无效的[6-10]。
LFIA的开发策略
LFIAs的开发的重点主要在于抗原抗体的相互作用的膜特性的标准化方面。毛细管流速主要取决于膜的物理和化学特性。检测的特异性和灵敏度取决于捕获和检测抗体的表位特异性以及检测抗体与胶体金纳米粒子的生物结合效率。条状试剂的设计包括按样品垫、结合垫、硝化纤维素膜和吸收垫的顺序重叠排列的膜。当我们将全血样品作为分析物时,还需要使用额外的膜来分离血细胞和清除背景。一个典型的LFIA条带由上述的膜组成,依次排列在塑料背板上的条带,并被放置在特殊设计的卡盒中,以保证适当的流速和稳定性(图1a,b)。
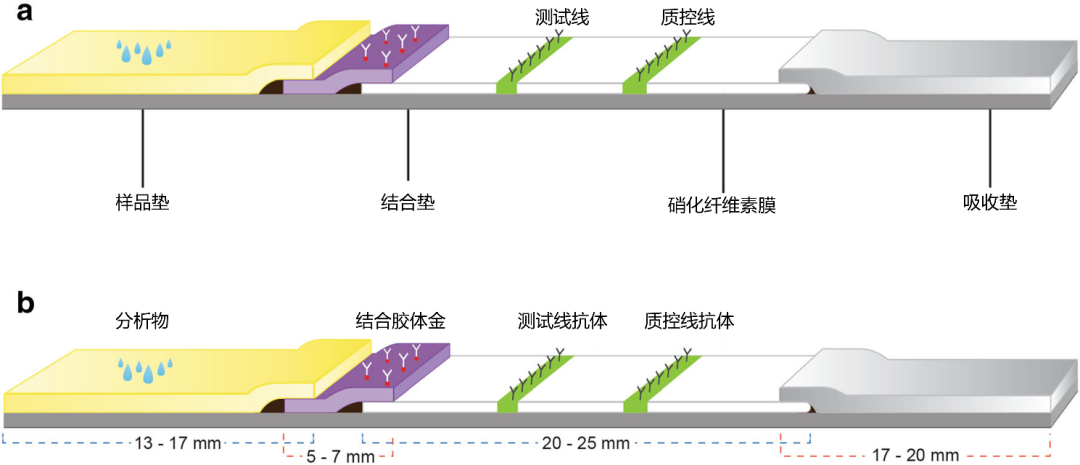
图1 | (a) LFIA条带的典型结构。(b) 带状排列模式与膜的大致长度
LFIA的重要组成部分
硝化纤维素膜
硝化纤维素(NC)膜被认为是快速检测条的骨架,测试线和质控线的捕获抗体被涂在这里。在确定硝化纤维素膜的孔径时,必须考虑分析物的大小和样品类型(全血、血清、血浆、尿液)。随着孔径的增加,膜的流速也会增加。检测的灵敏度与孔径大小成反比。NC膜本质上是中性的,可以通过硝酸酯与蛋白质的肽键之间的偶极-偶极作用与蛋白质静电结合。捕获试剂的缓冲液的pH值必须根据所用蛋白质的等电点进行优化,以增强静电作用。
NC膜的孔径范围为1-20 μm,根据分析物的特性来选择。NC膜可以根据孔径大小或吸水时间来评定。随着孔径的减小,吸水时间增加,为抗原-抗体提供足够的相互作用时间,从而提高检测的灵敏度。根据我们的经验,建议HCG使用10 μm的膜,疟疾和登革热快速检测使用15 μm的膜。通常NC膜的长度为20-25 mm,宽度为3-4 mm。测试线涂层与样品垫的距离应至少为7 mm,测试线与质控线之间的距离应至少为5 mm。由于NC膜容易受潮,所以应始终保持相对湿度(RH)低于40%的干燥状态。在检测的发展过程中,最好将NC膜保持在25℃,RH<40%的控制环境中,以获得一致的结果。一旦捕获试剂被涂在膜上,就必须使用真空干燥或37℃热风炉干燥1小时,甚至使用空气干燥器进行干燥。真空干燥不是首选,因为它对批量干燥来说是很困难的。37℃的热风炉中干燥1小时是合适的,因为大多数蛋白质可以在37℃的温度下不变性。
样品垫
纤维素或玻璃纤维被认为是合适的样品垫,作为样品分析的平台。最好是用玻璃纤维作为样品垫,因为它的蛋白质密度低,吸收能力强,能提供稳定而均匀的样品流向结合垫。样品垫是LFIA中预处理的主要部位,用于减少背景噪音和非特定的相互作用。预处理包括添加阻断剂如BSA(1%)、酪蛋白(0.1-0.5%)、明胶(0.05-0.1%)和表面活性剂如Tween-20(0.05%)、Triton X-100(0.05%)。用上述阻断剂和表面活性剂预处理过的样品垫(最好是在碳酸盐缓冲液或三相缓冲液中),然后在60-70℃的热风炉中干燥1小时。如果是全血样品,细胞分离膜用于支持样品垫,并与结合垫重合。
结合垫
玻璃纤维、纤维素薄膜和聚酯被用作结合垫的材料。结合垫是纳米粒子/微粒子与检测抗体/抗原结合的位置。它应该具有低蛋白结合性和高释放能力。浸渍和喷洒是用来将检测试剂涂在结合垫上的方法。应注意检测器颗粒在结合垫上的均匀扩散。浸泡过的垫子可以在37℃下干燥1小时,也可以用手持式空气干燥器进行干燥。结合垫是LFIA的一个重要组成部分,与NC膜一样重要。检测抗体结合的稳定性和释放动力学直接关系到检测的灵敏度。
吸收垫
吸收垫的常用材料是纤维素薄膜,其性质是高度极性的。它被放置在条带的下端,吸收膜上的全部溶液,提供最大的背景清除。在某种程度上,可以通过调整吸收垫的厚度和长度来提高检测的灵敏度。增加吸收垫的厚度可以解决试纸条中的回流问题。
捕获试剂
大多数LFIA都是基于免疫测定(夹心法)来检测体液中的抗体/抗原分析物。对于抗原检测来说,必须选择捕获抗体和检测抗体,以使表位结合位点彼此相距较远。一旦选择了捕获抗体,就必须将其涂在NC膜上。与其他免疫测定相比,LFIA对捕获抗体的浓度要求更高,每条的浓度从50到500 ng不等(条宽宽3-4 mm)。缓冲液的摩尔值和pH值对捕获抗体在干燥膜上的正确包被和稳定性有很大的影响。磷酸盐缓冲液或碳酸氢盐缓冲液是常用的,pH值必须根据蛋白质的等电点来优化。单克隆抗体是首选的捕获抗体,缓冲液的摩尔值应保持在较高的水平,以使分析物有适当的互动。为了增加捕获抗体在NC膜上的结合,可以在捕获试剂中使用1-3%的甲醇。
检测试剂
检测试剂负责LFIA中颜色的形成,这是因为在免疫测定(夹心法)反应中发生了纳米颗粒的聚集。金纳米粒子是广泛使用的与抗体结合的材料,因为它具有惰性和完美的球形结构。彩色乳胶微粒子、银纳米粒子、石墨烯纳米粒子也可用于LFIA的检测试剂制备。柠檬酸三钠还原法是制备胶体金纳米粒子的既定方法,纳米粒子的大小可以通过改变柠檬酸三钠的浓度来定制。通常情况下,20-80 nm的纳米颗粒被用于结合目的,40 nm是最好的选择。颗粒大小的变化可以通过分光光度计的吸光度扫描进行分析。纳米颗粒的颜色会随着尺寸的改变而改变(具体请见表1)。
表1 | 金纳米粒子的大小和颜色的形成
| 金纳米粒子的尺寸(nm) | 颜色 |
| 70-80 | 黑色 |
| 60-70 | 深紫色 |
| 40-60 | 粉紫色 |
| 20-40 | 带红色的粉红色 |
| 10-20 | 强烈的红色 |
金纳米粒子-抗体结合
检测抗体与金纳米粒子的结合效率可以被认为是成功开发LFIA的速度限制过程。结合缓冲液的pH值必须被优化,以使抗体分子完全与胶体金颗粒结合。pH值的优化是通过在2M氯化钠的存在下,在不同的pH值梯度下,将抗体和胶体金纳米粒子的结合缓冲液混合时检查聚集反应来进行的。在最佳的pH值下,所有的胶体金颗粒都同样被检测抗体结合,缓冲液中没有自由的金颗粒。如果pH值不理想,缓冲液中的游离金颗粒会与2M氯化钠发生反应,导致黑色的聚集反应(表2)。
表2 | 检测抗体结合的pH值优化实例
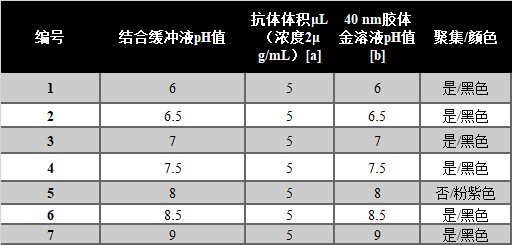
上述反应的最佳pH值为8.0,在此pH值下,纳米颗粒不会聚集。
[a]必须根据活性来确定抗体的浓度
[b]仅使用碳酸钾来调整胶体金溶液的pH值。不要使用HCL或NaOH
结合反应后,抗体包被的胶体金应该用阻断剂如牛血清白蛋白(1%)或明胶(0.5%)进行阻断。最后的储存缓冲液含有稳定剂如海藻糖(1-5%)或蔗糖(5-20%)。一旦准备好,抗体结合的胶体金溶液必须根据吸光度OD在储存缓冲液中稀释,然后涂在结合垫上,在37℃下干燥。常用的吸光度OD值为OD 10。结合抗体应在温度<25℃,相对湿度<20%的条件下保存。在控制湿度的条件下,干燥的检测试剂在结合垫上的稳定性可达3年。液体形式的结合检测试剂在4℃下最多可稳定1个月。
需要考虑的问题
1.胶体纳米粒子在结合时的吸收峰转移。
用柠檬酸三钠还原法制备的胶体金纳米粒子溶液将在520-524 nm处出现吸收峰。与检测抗体分子结合后,吸收峰将转移到528-530 nm。不建议使用吸收峰>531 nm的抗体结合金纳米粒子溶液,因为有可能发生聚集和沉淀。
2.在膜上阻断。
有两种在膜上阻断的选择;要么在样品垫上,要么在结合垫上。
3.检测抗体在金纳米粒子上的共价连接。
抗体和胶体金表面之间的离子吸引和疏水作用使LFIA的检测试剂制备中的连接物。可以使用连接剂如EDAC和NHS或适配器如链霉亲和素和生物素来实现检测抗体与金纳米粒子的共价结合。当然,共价连接将提供更好的连接稳定性,但对检测的灵敏度没有影响。建议对低吸附能力的分子使用共价结合法。共价结合会增加整个检测的成本。
4.LFIA的加速稳定性研究。
为了评估开发的生化或免疫测定试剂的长期稳定性,通常使用阿伦尼乌斯方程。但阿伦尼乌斯方程的计算方法不适用于LFIA测试。在37℃和45℃下30天的加速稳定性不足以声称所开发的检测方法具有2年的稳定性。
进行实时稳定性研究是声称LFIA产品保质期的唯一方法。
5.提高检测方法的灵敏度。
检测方法的灵敏度取决于各种因素。灵敏度可以通过减少孔径大小来提高,从而增加吸水时间。样品垫和结合垫中使用的表面性剂或洗涤剂会影响测定的灵敏度。优化这些表面活性剂的浓度是非常重要的。通过改变无衬垫条中膜之间的空气侧和带状侧的相互作用,有可能提高灵敏度。
6.LFIA推荐使用单克隆抗体还是多克隆抗体?
通常情况下,免疫测定(夹心法)更倾向于单克隆捕获抗体与多克隆检测抗体结合使用。但LFIA更倾向于使用具有远距离表位的单克隆抗体作为捕获抗体和检测抗体。检测试剂中的多克隆抗体会产生大的结构,导致在膜上的不适当的迁移和非特异性的保留。
7.乳胶微珠在LFIA上的应用
彩色的乳胶微粒子可以作为检测试剂用于LFIA中。羧基化的乳胶微粒子可以与蛋白质形成强烈的共价连接,在4℃下稳定多年。
LFIA开发过程中的故障排除

参考文献
[1] Anfossi L, Di Nardo F, Cavalera S, Giovannoli C, Baggiani C. Multiplex lateral flow immunoassay: an overview of strategies towards high-throughput point-of-need testing. Biosensors. 2018;9(1):2.
[2] Sajid M, Kawde A, Daud M. Designs, formats and applications of lateral flow assay: a literature review. J Saudi Chem Soc. 2015;19(6):689–705.
[3] Koczula K, Gallotta A. Lateral flow assays. Essays Biochem. 2016;60(1):111–20.
[4] Zherdev AV, Dzantiev BB. Ways to reach lower detection limits of lateral flow immunoassays. Moscow: IntechOpen; 2018.
[5] Posthuma-Trumpie G, Korf J, van Amerongen A. Lateral flow (immuno) assay: its strengths, weaknesses, opportunities and threats. A literature survey. Anal Bioanal Chem. 2008;393(2):569–82.
[6] Murray C, Gasser R, Magill A, Miller R. Update on Rapid Diagnostic Testing for Malaria. Clin Microbiol Rev. 2008;21(1):97–110.
[7] Wong R, Tse H. Lateral flow immunoassay. New York: Springer; 2010.
[8] Posthuma-Trumpie G, Korf J, van Amerongen A. Development of a competitive lateral flow immunoassay for progesterone: influence of coating conjugates and buffer components. Anal Bioanal Chem. 2008;392(6):1215–23.
[9] Hristov D, Rodriguez-Quijada C, Gomez-Marquez J, Hamad- Schifferli K. Designing paper-based immunoassays for biomedical applications. Sensors. 2019;19(3):554.
[10] Linares E, Kubota L, Michaelis J, Thalhammer S. Enhancement of the detection limit for lateral flow immunoassays: evaluation and comparison of bioconjugates. J Immunol Methods. 2012;375(1–2):264–70.
来源:诊断科学
声明:本网站注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!




